草苺以走莖無性繁殖為主,非常易受病毒、菌質、細菌、真菌與線虫等病原之為害而影響草苺產量與品質。因此若欲減少病害之發生與防治成本,每年更換母株繁殖為較適宜之措施。Belkengren 與Miller首先建議利用分生組織培養技術去除病毒,以獲得健康草苺種苗。
頂端分生組織與莖頂組織之區別
1952年Morel與Martin自感染病毒之大理花植株中,利用莖頂組織培養方式再生得無病毒之植株後,此種組織培養技術旋即被廣為應用在許多作物之去除病毒病害研究。這技術之可以獲得無病毒之植株主要理論基礎是病毒濃度於感染植株中之分佈不均勻所致,又一般而言,頂端分生組織因細胞分裂快速,又缺維管束與細胞間連絡絲,使病毒無法移行向上。
頂端分生組織(apical meristem)是芽尖端之圓頂組織,直徑大約為0.1mm,長約0.25-0.3 mm,於其下方有許多脊狀物,逐漸成長為原葉體(leaf primodia) 。至於莖頂(shoot tip)是指頂端分生組織加上一個或數個原葉體的部分。切取頂端分生組織或莖頂組織所獲得的再生植株,其遺傳特性與原母株相同,大可減少變異之可能,唯單獨之頂端分生組織苗在瓶內之存活率甚低,必須用人海戰術多切取頂端分生組織方較易成功。
草苺之莖頂組織培養技術
選取5公分之草苺走莖,以解剖刀切成單節間之小節,並修剪去除較大葉片(注意勿用手觸摸,請用鑷子夾取!) 。將這些含側芽之小節走莖放置入500 ml之燒杯中,以紗布封口並用橡皮筋緊固,再以自來水沖洗15分鐘。在等待之餘,以95%酒精擦拭無菌操作檯,置入解剖顯微鏡,以75%酒精完全擦拭乾淨,並以95%酒精噴佈置物架,待酒精揮發後,點燃本生燈或酒精燈。將解剖刀、稱藥匙、鑷子浸在95%酒精中,經火燄消毒後放在置物架上冷涼,同時準備配製消毒液(20 ml Clorox 漂白水與80 ml 無菌水,再滴入2滴Tween-20) 。將沖洗15分鐘後的含草苺段燒杯,倒去水,移去紗布,拿入無菌操作檯中,以消毒冷卻過的鑷子夾取走莖段置入消毒瓶中,加入足量的75%酒精搖動30秒鐘,倒去酒精後,再加消毒液於消毒瓶中,蓋上瓶蓋及鋁箔紙螺旋轉動10分鐘。在無菌操作檯中,倒除消毒液後,加入無菌水漂洗二次,每次五分鐘。將草苺培養基(配方如附表一)排好在試管架上,噴灑75%酒精行表面消毒。置放消毒過的培養皿在解剖顯微鏡的載物台上,以消毒過的鑷子取出消毒過的草苺走莖片段,放在培養皿中,並用鑷子固定走莖,注意到鼓起的地方即為芽苞葉處以解剖刀橫切取芽苞葉下方的節間,如圖二所示,輕輕縱切芽苞,再用鑷子剝去苞葉,側芽可能與剝離的芽苞仍相連接或與走莖相連。再以消毒過之11號解剖刀切取側芽,從其基部細片薄切去除原葉體,直到頂端分生圓頂組織與雙對原葉體清楚可見,然後仔細地切取頂端0.5-1.0 mm之組織塊,以消毒過之稱藥匙移取此莖頂組織至培養基中,封蓋並以一層Nescofilm 或Parafilm隔絕,在22-25℃下每日光照培養16小時(58-65μmol m-2s-1) 。
病毒檢定法
1.嫁接法:
為確保從莖頂組織培養所獲得之草苺苗為無病毒苗,常切取一葉片嫁接至指示草苺品種(F. vesca UC4 、UC5、UC6或UC 10等)上,再觀察病徵之表現。
2.電子顯微鏡檢查法:
由於病毒濃度在組培苗中不高,以普通之陰染法直接電顯鏡檢,不易檢出;因此利用CVC(clarified viral concentrates)之部分純化法濃縮病毒,再配合陰染法檢查以確定無病毒之感染。
3.血清檢測法:
有些草苺病毒之抗血清已商品化,例如strawberry latent ringspot virus 和arabis mosaic virus等,可利用酵連抗體免疫測定法(ELISA)或組織直接點漬法(Direct Tissue Blotting)等法測知該病毒之存在否。
草苺的莖頂組織培養去除病毒方式,其莖頂組織大小與瓶內存活率有正相關性之存在;但與病毒去除率有逆相關性。一般選用0.5 mm之莖頂組織,其瓶內存活率約50%,而病毒去除率高達95%;然而選用1.0 mm之莖頂組織可增加其瓶內存活率至70%,但相對地病毒去除率只有50%。雖然頂端分生組織培養技術與莖頂組織培養技術是最常用之去病毒方式,然而有些病毒確不易單靠此技術獲得無病毒組培苗,必須配合熱療法(thermotherapy)或化學療法(chemotherapy)以增加成功率。

利用莖頂組織培養技術之草苺組培苗於瓶內生長情形。
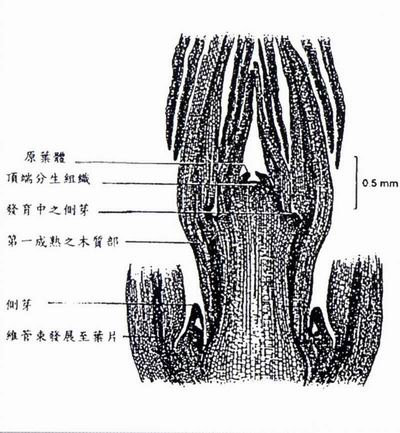
莖頂(shoot tip)係由頂端分生組織(apical meristem)與包在葉腋之原葉體(leaf primodia)所組成。
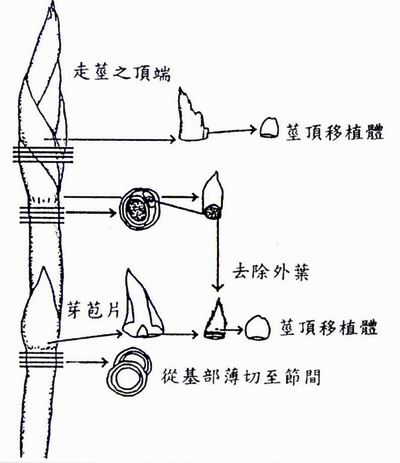
草苺莖頂組織之分離獲取程序
資料來源:
楊佐琦 1998 無病毒草苺組織培養繁殖技術 種苗科技專訊第21期 農林廳種苗改良繁殖場
相關照片
